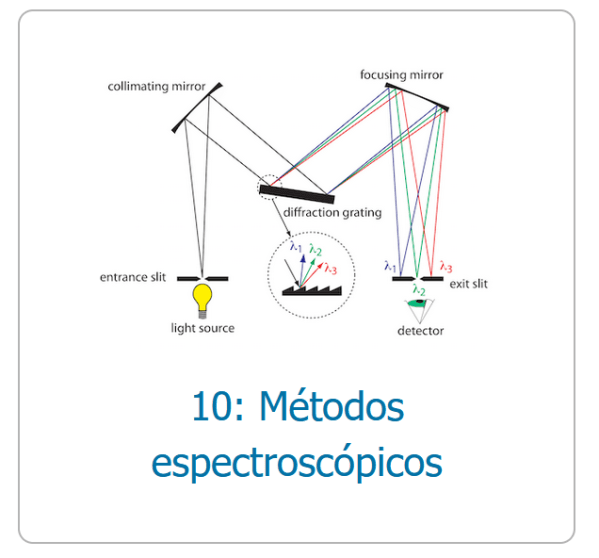
Tot i que el descobriment de la dispersió de la llum per Newton data del 1704 el camí cap al desenvolupament de les tècniques experimentals d’espectroscòpia tal i com les coneixem va trigar més de dos-cents anys.
Un segle després (1814) Fraunhofer va crear un sistema òptic, el primer espectroscopi?, que va permetre detectar a l’espectre de la llum solar les línies d’absorció que porten el seu nom. En aquest espectre es va trobar que al Sol hi havia abundant heli, una vegada que va quedar clar que cada element químic posseeix un espectre característic de línies d’emissió. Això últim va ser gràcies a Bunsen i Kirchhoff que es poden considerar els fundadors de l’anàlisi espectral i que van ser els primers en construir un equip prou pràctic per ser utilitzat habitualment.
A finals del segle XIX l’espectroscòpia d’emissió atòmica ja posseïa aplicacions pràctiques especialment per a la determinació de metalls en minerals.
La teoria i la pràctica de l’emissió atòmica és ben coneguda pels estudiants de secundària. Forma part del currículum de química de l’ESO i sobre tot del batxillerat i sobre ella es fan pràctiques, tant d’assaigs a la flama, com de mirar l’espectre emès a través d’un prisma o una xarxa de difracció (espectroscopi de prisma o de xarxa de difracció).
L’espectroscòpia d’absorció molecular a les regions ultraviolada i visible, l’espectroscòpia UV-visible que estudiarem en aquesta entrada, només va assolir-se a partir dels anys 30 del segle passat. Quan als anys 40 es van poder substituir als equips els sistemes de detecció fotogràfica (poc eficients, molt ortopèdics) pels nous sistemes de detecció fotoelèctrica es va generalitzar aquesta tècnica espectroscòpica.
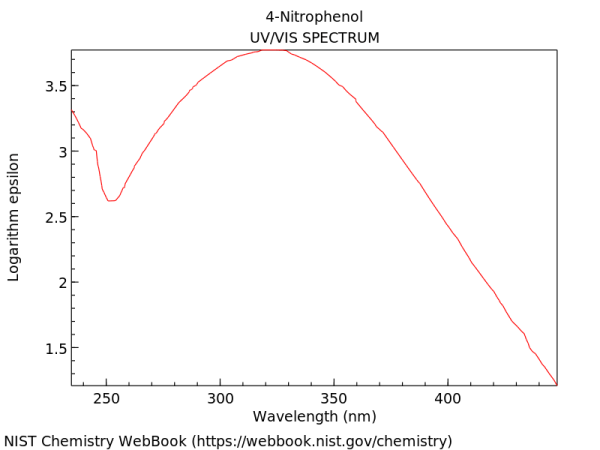
Les radiacions ultraviolades i visibles tenen en comú el fet que l’absorció a les dues regions provoca l’excitació d’electrons a nivells d’energia superiors. Però la major part de les vegades l’excitació electrònica va acompanyada de canvis vibracionals i rotacionals de les molècules i, per això, el que podrien ser fines línies d’absorció apareixen als espectres de la regió ultraviolada-visible com una banda ampla. Com exemple, a sota teniu l’espectre UV-Vis del nitrofenol, amb un màxim que el defineix a 325 nm. Malgrat que aquest gràfic s’acaba als 450 nm, la regió que abarquen els espectres d’aquestes radiacions ultraviolades i visibles va de 200 a 800 nm.
Aquesta tècnica és complementària de l’espectrometria de fluorescència, que tracta amb transicions electròniques des de l’estat excitat a l’estat fonamental, al inrevés de l’espectrometria d’absorció.
L’anàlisi UV/Vis va ser un dels primers mètodes físics que s’aplicà a l’anàlisi quantitativa de solucions d’ions metàl·lics de transició i compostos orgànics molt conjugats i a la determinació de les seves estructures químiques. Si bé l’espectroscòpia infraroja i de ressonància magnètica nuclear són les tècniques més idònies per a l’anàlisi qualitativa i estructural, l’espectroscòpia (d’absorció molecular) ultraviolada-visible supera la resta de mètodes òptics d’anàlisi pel que fa a l’anàlisi quantitativa, encara que també és una tècnica auxiliar útil per a l’elucidació d’estructures, aportant dades valuoses en la identificació de grups absorbents i d’estructures de compostos orgànics. Tanmateix, disposar només d’aquests espectres no permet arribar a cap conclusió, sinó que s’han d’usar en combinació amb altres tècniques.
Fonaments de l’espectroscòpia Ultraviolada-visible
Regions de l´espectre Ultravioleta-Visible
La regió de l’espectre electromagnètic que correspon a les transicions que involucren electrons de la capa de valència s’estén per longituds d’ona de 100 a 1000 nm (regions ultraviolada-visible i infraroja propera), encara que no tota aquesta zona és de la mateixa utilitat per a l’elucidació d’estructures orgàniques.
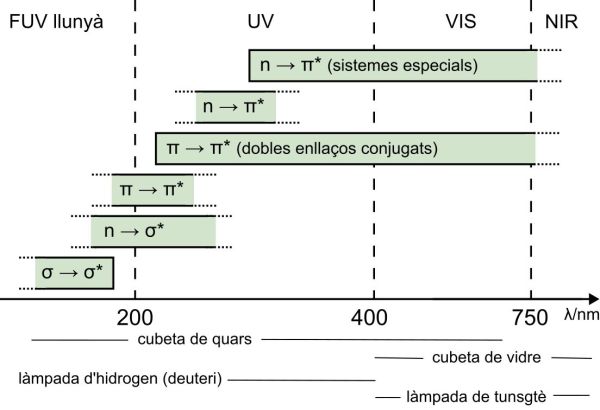
La regió per sota de 200 nm, coneguda com a ultraviolat llunyà, presenta característiques que fan complicada la seva utilització:
1. –En aquesta zona absorbeixen les molècules que componen l’aire, cosa que fa imprescindible treballar amb equips de buit (d’aquí el nom alternatiu de la regió: Ultraviolada de buit).
2. – Els materials usuals per a la construcció de components òptics (cel·les, lents, elements dispersius), el quars i el vidre, absorbeixen fortament en aquesta zona.
3. -Els solvents absorbeixen fortament en aquesta regió. Els hidrocarburs saturats es poden fer servir fins a 170 nm, els hidrocarburs perfluorats fins a 150 nm.
4. – La sensibilitat dels detectors és generalment baixa.
5. – L’absorció a aquesta zona és poc selectiva. Gairebé tots els compostos presenten absorció en aquesta regió.
La regió entre 200 i 400nm, anomenada ultraviolat proper, és de gran utilitat en la determinació estructural de les insaturacions conjugades, dels aromàtics o de certs grups insaturats amb parells electrònics lliures (carbonil, nitro, etc.), sense presentar els seriosos inconvenients de l’ultraviolat de buit. Es requereixen materials òptics de quars si es vol accedir a la zona de longituds d’ona inferiors a 350nm, mentre que el vidre és utilitzable a la resta de la regió ultraviolada propera i tota la regió visible.
La regió Visible, de 380 a 750nm, és l’única de l’espectre electromagnètic detectable per l’ull humà. Les transicions que es presenten en aquesta zona corresponen a transicions electròniques de baixa energia. Tots els compostos acolorits absorbeixen selectivament en aquesta regió. Els compostos fortament conjugats i certs complexos de metalls de transició absorbeixen significativament a la regió. Si un compost és blanc o incolor no absorbeix en aquesta regió. Certes transicions electròniques poden presentar-se a longituds d’ona superiors a 800nm però aquestes no són comunes als compostos orgànics.
Les transicions electròniques en molècules es presenten als espectres en forma de bandes, com ja s’ha comentat anteriorment, amb modificació simultània dels nivells d’energia vibracionals i rotacionals. Les bandes d’absorció es caracteritzen per la posició del màxim, la intensitat i l’amplada. La posició d’una banda ve donada pel màxim d’absorció, depèn de l’energia de la transició principal i s’indica normalment com a λmax en nm (lambda màxima). La intensitat d’una banda d’absorció es pot expressar com absorbància o com absortivitat molar (εmax) en el màxim (veurem aquests conceptes més endavant). L’amplada d’una banda d’absorció electrònica depèn del nombre i la intensitat dels components vibracionals de la transició corresponent.
Aquesta és una taula guia que indica aproximadament de quin color es veu una substància o solució si s’absorbeix el color especificat (Si es veu el color de la primera columna és que s’absorbeix el de la tercera, són aproximadament els colors complementaris de la llum).

Compostos orgànics
Els compostos orgànics absorbeixen en el rang de la llum ultraviolada-visible quan pateixen excitacions electròniques entre els seus orbitals moleculars. En els compostos orgànics ens trobem enllaços simples formats per orbitals s (enllaçants) i s* (antienllaçants) i dobles enllaços (de vegades triples) formats per orbitals π i π*. També poden formar part de les molècules orgàniques elements (oxigen, nitrogen, etc.) que tinguin orbitals atòmics no enllaçants n en la seva última capa.

Per exemple, el fenol està compost per un anell benzènic amb enllaços s i π i amb un oxigen que en té dos orbitals n ocupats per dos electrons cadascú.
Les possibilitats de salts electrònics en els compostos orgànics es poden resumir en un gràfic con el de sota.
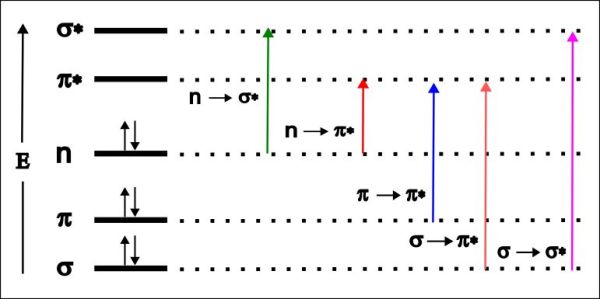
Com s’aprecia en el gràfic els salts entre els orbitals sigma, per exemple, són molt més energètics que entre els pi, el que fa que la longitud d’ona de la radiació absorbida en aquestes últimes transicions sigui molt més petita. Només els compostos orgànics amb un alt grau de conjugació, amb molts dobles enllaços conjugats, absorbeixen llum en la regió visible de l’espectre electromagnètic quan pateixen salts entre enllaços moleculars pi .
El següent gràfic representa la relació entre les diferents transicions electròniques possibles i la longitud d’ona λ absorbida expressada en nanòmetres (nm), el que és el mateix, la zona de l’espectre electromagnètic en que els compostos absorbiran.
També es representa el tipus de material del que ha d’estar feta la cubeta que contingui la mostra per a realitzar l’anàlisi, ja que el vidre absorbeix molt en la zona ultraviolada, i el tipus de làmpada que ha d’il·luminar les mostres per aconseguir llum ultraviolada o visible.
Al grup d’àtoms d’una molècula amb enllaços covalents insaturats conjugats que origina bandes d’absorció electròniques (ππ*) s’anomena grup cromòfor (que dona color). Exemples típics són els grups vinil, carbonil, fenil, nitre. Per altra banda les molècules poden tenir a més a més del grup cromòfor grups d’àtoms amb enllaços simples (grup saturat) però que contenen parells electrònics lliures que alteraran tant la posició com la intensitat de la banda d’absorció d’aquest. S’anomenen grups auxocroms, i són per exemple -OH, -NH2, -Cl, -B.
Si un compost és incolor o de color blanc és perquè no absorbeix en el rang de la llum visible, i ho farà a la ultraviolada. Per a que una molècula orgànica sigui acolorida ha de tenir un mínim de set enllaços dobles conjugats.
Els dissolvents per a fer aquestes determinacions són sovint l’aigua, etanol o benzè o tetraclorur de carboni, per exemple, en funció de la solubilitat de les mostres a analitzar. L’etanol absorbeix molt dèbilment en la majoria de longituds d’ona, però els dissolvents orgànics poden tenir una significativa absorció d’UV, de manera que no tots els dissolvents són adequats per al seu ús en espectrometria UV. A més la polaritat i el pH del dissolvent poden afectar molt l’absorció a l’espectre d’un compost orgànic, per això us podeu trobar espectres prou diferents del mateix compost en funció del dissolvent en el que s’han realitzat.
Així en podem trobar efectes batocròmics o hipsocròmics que corresponen a desplaçaments a l’espectre d’un compost del màxim d’absorció d’una banda a longituds d’ona majors o menors respectivament, a causa de la introducció d’un substituent, canvi de solvent o pH o qualsevol altra causa. També pot passar pels mateixos motius que augmenti o disminueixi la intensitat d’una banda d’absorció, llavors s’anomenen efectes hipercròmic i hipocròmic, respectivament.
Les regles de Woodward-Fieser són un conjunt d’observacions empíriques que poden utilitzar-se per predir la longitud d’ona de l’absorció UV-Vis, la λmax, de compostos orgànics conjugats com diens i cetones. Per exemple, poeu mirar aquestes taules de la web Quiroled de la Universitat de Granada.
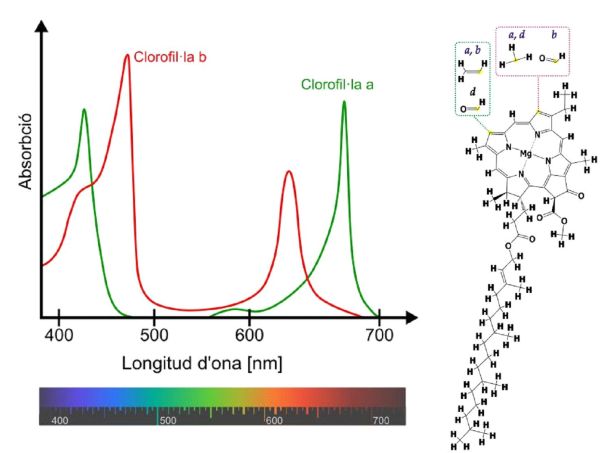
Com exemple d’una molècula orgànica amb gran quantitat de dobles enllaços conjugats tenim la clorofil·la (mireu la fórmula) que és una substancia present als vegetals, fonamental pera que puguin realitzar la fotosíntesi. A la gràfica de sota hi és l’espectre UV-Vis de les dues formes a i b de la clorofil·la. Com s’aprecia la clorofil·la absorbeix la radiació de la zona blava i vermella del espectre visible de la llum, per la qual cosa la veiem de color verd.
Chlorophyll_structure.svg
Compostos inorgànics
Els compostos i les solucions d’ions metàl·lics de transició poden ser acolorits (és a dir, absorbeixen part de la llum visible) pel fet que els electrons en els àtoms de metall es poden excitar des d’un estat electrònic a un altre. El color de les solucions d’ions metàl·lics es veu molt afectat per la presència d’altres espècies, com alguns anions o lligands. Per exemple, el color d’una solució diluïda de sulfat de coure és blau, però si afegim amoníac s’intensifica molt el color i canvia la longitud d’ona d’absorció màxima (de 837 a 608 nm). La demostració als laboratoris escolars del canvi de color quan s’afegeix amoníac a una dissolució de sulfat de coure (II) és un clàssic (mireu Experimentos de química recreativa con sulfato de cobre pentahidratado de Santiago Heredia, pag. 472).
A causa de la seva baixa electronegativitat, els metalls de transició es troben als compostos com a ions carregats positivament, o cations. Quan els compostos que contenen metalls de transició estan dissolts els ions metàl·lics, per exemple el coure (Cu2+) no es troben ells sols, sinó que atrauen altres molècules cap a ells, per exemple d’aigua (Cu(H2O)62+), o amoníac (Cu(NH3)4(H2O)22+). Aquestes molècules s’uneixen als ions metàl·lics i formen complexos de coordinació.
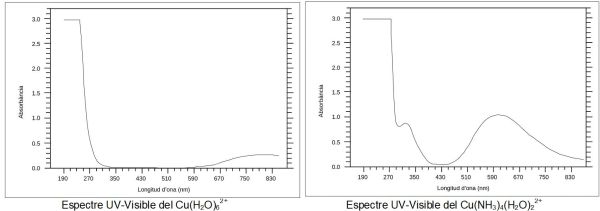
Aquests complexos de metalls de transició o complexos de coordinació tenen molts electrons en els seus orbitals de valència d, a més dels que tenen els lligands, susceptibles de realitzar transicions electròniques amb facilitat. Una transició molt comú s’anomena transició de transferència de càrrega i implica l’excitació d’un electró del lligand al metall o viceversa. A més, amb presència de lligands els diferents orbitals d de l’últim nivell energètic dels metalls de transició es desdoblen i els electrons poden excitar-se d’un orbital a un altre dins l’ió metàl·lic, es a dir són transicions electròniques d-d.
En principi sembla que aquestes transicions d-d podrien ser força fàcils ja que el salt energètic és prou petit, però les transicions d-d són en realitat força ineficients. En comparació, pot semblar que seria difícil moure un electró des del metall fins al lligand, però en realitat és força fàcil. Aquestes transicions electròniques entre els lligands i el metall interactuen amb els fotons de manera molt eficient i són les responsables de l’absorció dels compostos dels metalls de transició a l’UV/Vis.
Llei de Beer-Lambert
Sobre tot l’espectrometria UV-Vis s’utilitza de forma quantitativa per determinar les concentracions de les espècies químiques en solució utilitzant la Llei de Beer-Lambert:
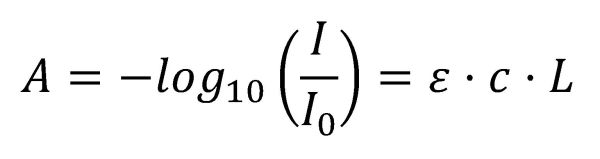
on A és l’absorbància, I0 és la intensitat de la llum incident en la mostra amb una determinada longitud d’ona, I és la intensitat de transmissió, L la longitud de ruta a través de la mostra, c la concentració de les espècies absorbents i ε el coeficient d’absorció. De vegades l’absorbància es defineix en termes de logaritme neperià en lloc de logaritme de base 10.
Per tant la llei de Beer-Lambert estableix que l’absorbància d’una solució és directament proporcional a la concentració de la solució, amb la qual cosa l’espectrometria UV/Vis es pot utilitzar per determinar concentracions. La llei funciona a concentracions baixes, amb solucions prou diluïdes de concentracions de 10-2 a 10-5 molL-1. A concentracions elevades la llei no s’acompleix, i a més pot saturar-se l’espectre.
És possible abordar aquesta llei al laboratori escolar amb l’ajut del sensor de llum d’un telèfon mòbil com mostro a l’entrada Llei d’absorció de la llum de Beer-Lambert amb telèfon mòbil d’aquest mateix bloc.
Per a cada espècie i longitud d’ona, ε és una constant coneguda com absortivitat molar o coeficient d’absorció molar. Aquesta constant és una propietat fonamental de la molècula a una longitud d’ona donada, en un solvent donat, a una temperatura i pressió particular, i té com a unitats 1/M·cm (L/mol·cm) o L/g·cm.
Per realitzar els càlculs s’ha de conèixer el coeficient d’absorció molar, que es pot obtenir a partir de taules ja elaborades o, amb més exactitud, determinar-lo per al cas que interessi a partir d’una corba de calibratge feta a partir de mostres de concentració coneguda de la substància que s’estudia. En alguns casos aquesta corba de calibratge és absolutament necessària, per exemple en el cas de molècules complexes de grans dimensions, com els tints orgànics en els que de vegades es troba una relació polinòmica de segon ordre entre l’absorció i la concentració.
Alguns exemples d’espectres d’UV-visible
Un espectre ultraviolat-visible és essencialment un gràfic d’absorbància de llum davant la longitud d’ona en el rang de l’ultraviolat i/o la llum visible. De la mateixa manera, per a la mateixa substància, pot fer-se un gràfic del coeficient d’absorció (ε) enfront de la longitud d’ona (λ). Aquest últim gràfic seria independent de la concentració.
Aquí sota teniu l’espectre UV de la piridina en el que es representa el logaritme del coeficient d’absorció en funció de la longitud d’ona en el que s’aprecia un màxim a 255 nm i després varis entre 320 i 400 nm que corresponen l’anell aromàtic. Com tota l’absorció de la llum es realitza en el rang de l’ultraviolat aquest compost no és acolorit.
L’espectre està obtingut de la base de dades del National Institute of Standars and Technology (NIST) del Departament de Comerç dels Estats Units, on es pot buscar en anglès i castellà per diversos conceptes. De totes maneres no tenen disponible l’espectre UV de la majoria dels compostos.
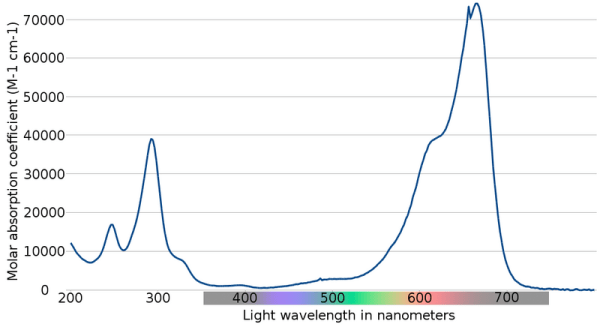
Aquest altre espectre, del blau de metilè, representa el coeficient d’absorció molar (no el seu logaritme) davant la longitud d’ona, amb una forta absorció a la zona del vermell (600 – 700 nm), el que es correspon amb el color amb el que veiem aquesta substància.
Espectrofotòmetre UV-visible
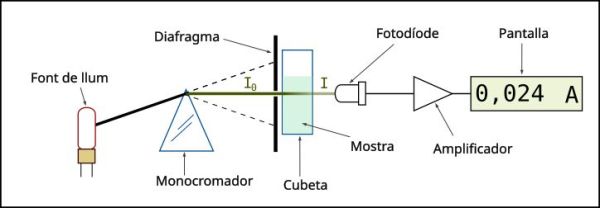
L’instrument utilitzat en la espectrometria ultraviolada-visible es diu espectrofotòmetre UV-Vis. Mesura la intensitat de llum (I) que passa a través d’una mostra, i la compara amb la intensitat (I0) abans de passar a través de la mostra. La relació I/I0 es diu transmitància, i s’expressa habitualment com un percentatge (%T). L’absorbància (A) es basa en la transmitància:
A = – log (%T)
Les parts bàsiques d’un espectrofotòmetre són una font de llum (sovint una bombeta halògena de wolframi per a les longituds d’ona visibles, o una làmpada d’arc de deuteri a l’ultraviolat), un suport per a la mostra, una reixeta de difracció o monocromador per separar les diferents longituds d’ona de la llum, i un detector. El detector sol ser un fotodíode o un CCD. Els fotodíodes s’usen amb monocromadors, que filtren la llum de manera que una sola longitud d’ona arriba al detector. Les reixetes de difracció s’utilitzen amb CCDs, que recullen la llum de diferents longituds d’ona en píxels.

Un espectrofotòmetre pot ser únic o de doble feix. En un instrument d’un sol feix tota la llum passa a través de la cubeta amb la mostra, i en aquest cas la Io (intensitat de la llum que incideix a la mostra) s’ha de mesurar retirant la mostra. Així eren els espectrofotòmetres al començament i encara estan en ús a l’ensenyament i als laboratoris industrials. Aquí teniu una mica d’història d’aquests aparells.
En un instrument de doble feix la llum es divideix en dos feixos abans d’arribar a la mostra. Un feix s’utilitza com a referència i l’altre feix de llum passa a través de la mostra. Alguns instruments de doble feix tenen dos detectors (fotodíodes), i el feix de referència i el de la mostra es mesuren al mateix temps. En altres instruments, els dos feixos passen a través d’un bloquejador que impedeix el pas d’un feix. El detector alterna entre la mesura del feix de mostra i la del feix de referència.
Les mostres per espectrofotometria UV-Vis solen ser líquides (dissolucions), encara que la absorbància dels gasos i fins i tot dels sòlids també pot mesurar-se. Les mostres es fiquen en una cèl·lula transparent que es diu cubeta. Les cubetes solen ser rectangulars, amb una amplada interior d’1 cm. Aquesta amplada es converteix en la longitud del pas, L, en la Llei de Beer-Lambert. També es poden fer servir tubs d’assaig com a cubetes en alguns instruments. Les millors cubetes estan fetes amb quars d’alta qualitat, encara que són comuns les de vidre o plàstic. El vidre i la majoria dels plàstics absorbeixen a l’UV, la qual cosa limita la seva utilitat a longituds d’ona visibles.
Exemples de problemes resolts
1 Concentració de cafeïna en el cafè
Interessa determinar la concentració de cafeïna en dos tasses de cafè de procedències diferents (tassa 1 i tassa 2) per tal de determinar quina és la més excitant. Amb cafeïna purificada es preparen soluciones estàndard de cafeïna de diferents concentracions. Després, amb l’ajut d’un espectrofotòmetre es mesura l’absorbància A de les diferents dissolucions preparades de cafeïna i de les dues tasses de cafè.
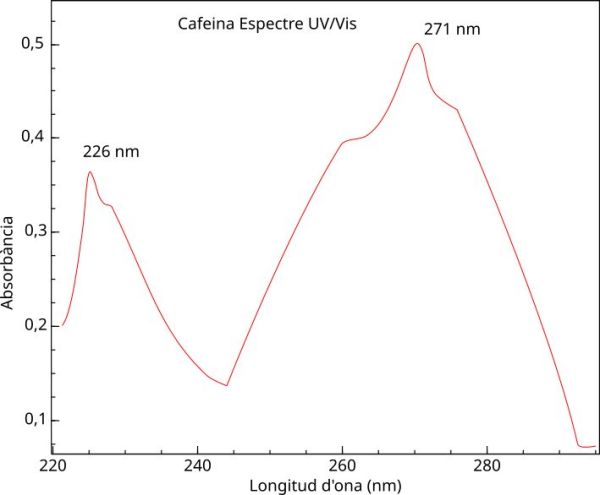
A partir de la cafeïna purificada se prepara una dissolució de cafeïna en diclorometà de concentració 40 mg/L, i partir d’aquesta dissolució s’obtenen les solucions estàndard de concentracions donades més petites. Amb una d’aquestes dissolucions, de 18,0 mg/L, es realitza l’espectre d’absorció de la cafeïna entre els 220 i els 300 nm i dona com a resultat el gràfic de la figura 1.
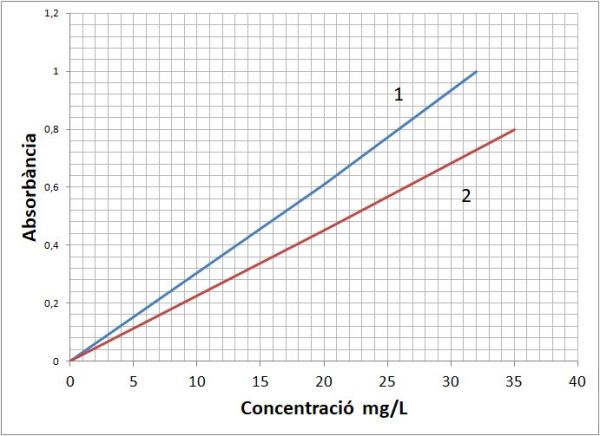
A continuació, es mesura l’absorció per a dues longituds d’ona determinades de totes les mostres preparades i es construeix la gràfica que es pot veure a la figura 2.
Responeu a les següents preguntes:
- Perquè és important treballar amb concentracions diluïdes en espectroscòpia UV-Vis?
- En quin rang de l’espectre electromagnètic es troben les longituds d’ona d’absorció de la cafeïna que estem estudiant? (figura 1)
- En quina longitud d’ona és convenient treballar per tal d’obtenir la millor precisió possible?
- Atribuïu cadascuna de les línies de calibratge a la longitud d’ona de treball. (figura 2)
- A λ = 271 nm s’obté A1 = 0,24 per la tassa 1 i a A2 = 0,56 per la tassa 2. Quina és la beguda més excitant de les dues? Determineu la concentració en cafeïna para cadascuna de les begudes de les tasses.
Solució a les preguntes
- La llei de Beer-Lambert només és vàlida per a concentracions febles. Per damunt de determinats valors l’absorbància no és proporcional a la concentració.
- El rang és el de l’ultraviolat (λ < 400 nm).
- Normalment s’ha de treballar a la longitud d’ona on l’absorbància sigui màxima per tal d’aconseguir la millor precisió possible, en aquest cas a 271 nm.
- Tal i com es veu a la figura 1, l’absorbància és més gran a 271 que a 226 nm. La recta de calibratge 1 de la figura 2 té un pendent més gran que la recta 1, per tant és la que correspon a la longitud d’ona de treball de 271 nm, i l’altra recta, la 2, a λ = 226 nm.
- El cafè de la tassa 2 presenta una absorbància (0,56) molt més gran que el de la tassa 2 (0,24). Si es fa la lectura gràfica a la recta 1 de la figura 2 s’obté per a la tassa 1 una concentració de 8 mg/L, i per a la tassa 2 una concentració més gran de 18,5 mg/L.
2 Sulfat de coure (II) en dissolució
Es prepara una dissolució 4,0·10-3 mol/L de sulfat de coure (II) en aigua a partir d’una altra més concentrada d’0,1 mol/L i s’obté el seu espectre ultraviolat-visible, que està representat en la gràfica de sota. La cubeta utilitzada a l’espectrofotòmetre té una amplada interior L igual a 1,0 cm.

A l’espectre UV/vis s’observa un màxim d’absorbància d’1,28 a la longitud d’ona λ = 837 nm. Per altra banda, l’espectre correspon a l’interval de longituds d’ona comprés entre el 400 i els 850 nm i a la taula de sota hi és la relació entre alguna d’aquestes longituds d’ona i el color aproximat de la llum que els hi correspon.

Responeu a les següents preguntes:
- Perquè es dilueix la solució inicial?
- A quin rang de l’espectre electromagnètic correspon la longitud d’ona en la que l’absorbància és màxima?
- Quines són les longituds d’ona més absorbides per la solució?
- Com podeu justificar que les dissolucions de sulfat de coure en aigua siguin de color blau?
- Trobeu el coeficient d’absorció (ε) a λmax utilitzant la llei de Beer-Lambert.
Solució a les preguntes
- La solució inicial és massa concentrada i si s’utilitzés directament saturaria la senyal de l’espectre, i a més a més no s’acompliria la llei de Beer-Lamber.
- El rang és el de l’infraroig proper (IR) (>750 nm).
- Encara que l’absorció comença a una 550 nm, es pot dir que la zona on hi ha més absorció és entre el 650 i més dels 900 nm.
- La dissolució del sulfat de coure absorbeix totes les radiacions vermelles deixant passar la resta de la llum visible, bàsicament els blaus (violat, blau, cian), és a dir el color complementari al vermell.
- La llei de Beer-lamber indica que l’absorbància (A) és directament proporcional al coeficient d’absorció (ε), a la longitud que recorre la llum en la solució (L) i a la concentració d’aquesta (C): A = ε·L·C. Si aïllem el coeficient ε, tenim:
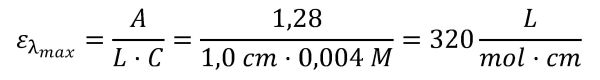
Enllaços per ampliar informació
La Royal Society of Chemistry va publicar fa temps un llibre titulat Modern Chemical Techniques : An Essential Reference for Students and Teachers amb propostes per estudiar tècniques d’anàlisi espectroscòpic al que seria el nostre batxillerat (16 – 18 anys). Actualment (2015) amb el nom de Modern Chemical Techniques: background reading for chemistry teachers ha ficat a l’abast de tothom en format PDF i per capítols el contingut actualitzat d’aquell llibre. En concret pel que aquí interessa la unitat Modern chemical techniques: ultraviolet/visible spectroscopy.
“Mejorando lo presente” ;-), són unes unitats molt ben fetes. En particular us recomano que estudieu l’últim problema que es proposa en aquesta unitat d’espectroscòpia UV/Vis (pàg. 113). Es tracta de l’estudi quantitatiu de la hidròlisi d’un èster en dissolució bàsica, del 4-nitrofeniletanoat, fent el seguiment del desenvolupament de la hidròlisi mitjançant la mesura de l’absorbància de la dissolució al llarg del temps.
A la web de Libretexts. Español es troben gran quantitat de llibres en espanyol de diferents disciplines i de lliure accés amb llicència de creative commons. Entre ells, a l’apartat de Química General, està Estructura y Reactividad en Química Orgánica, Biológica e Inorgánica II: Aspectos Prácticos de la Estructura – Purificación y Espectroscopia , que conté un capítol dedicat a l’Espectroscòpia ultraviolada – visible amb exercicis resolts intercalats a la teoria. El llibre ha estat escrit pel professor Chris Schaller del College of Saint Benedict a la Saint John’s University.
A la mateixa web de Libretexts. Español també teniu un capítol dedicat a l’espectroscòpia basada en l’absorció dins el llibre Química Analítica 2.1 de David Harvey de la Pauw University.