Experiment a l’Any Internacional de la Ciència i la Tecnologia Quàntica 2025 (IYQ2025).
Aquesta entrada que us anima a reproduir els estudis de Johann Balmer i Johannes Robert Rydberg és la transposició a format web d’un protocol per a calcular la constant de Rydberg a partir de les línies espectrals de l’hidrogen que vaig elaborar fa molt de temps a partir d’una idea (Experimento 60) de la Guía del laboratorio de física (1969) del Physical Science Study Committee (PSSC).
M’ha semblat però, que encara que el protocol ja estava fet, era d’interès incloure’l en aquesta sèrie que estic realitzant sobre experiments en la història de la Física Quàntica que es poden realitzar en un laboratori escolar, ja que la interpretació dels espectres atòmics va ser un dels punts clau per a consolidar la idea de la quantificació de l’energia.
La constant de Rydberg
Niels Bohr va proposar en 1913 una teoria per a l’àtom d’hidrogen que tenia en compte les propostes quàntiques de Planck i Einstein i que portava a establir la longitud d’ona de les radiacions de llum emeses per l’àtom d’hidrogen segons l’equació:
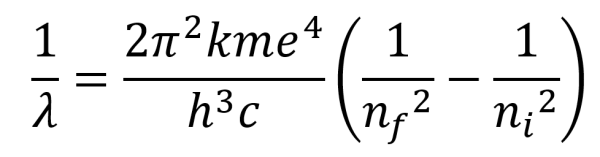
que era formalment idèntica a la que Rydberg havia obtingut a partir de l’equació de Balmer, que aquest últim havia aconseguit en adonar-se que els valors del nombres d’ona de les ratlles espectrals de l’hidrogen en el visible seguien un patró (sèrie de Balmer).

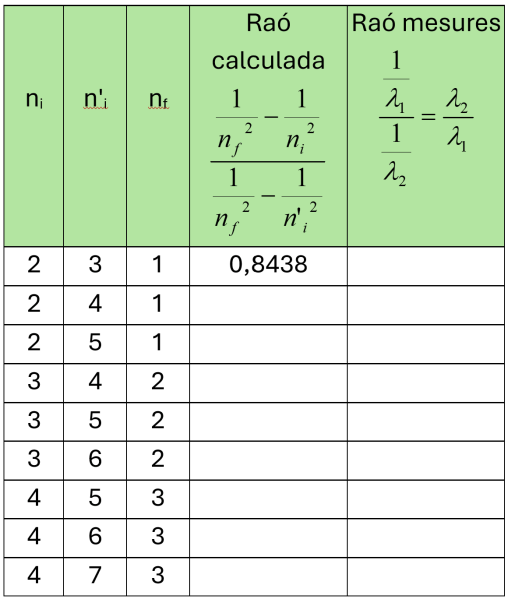
λ és la longitud d’ona de la radiació que emet un electró quan salta del nivell ni al nf a l’àtom d’hidrogen. R és la constant de Rydberg que engloba a la constant de Planck h i altres constants de valor:
- Contant de Planck: h = 6,625 x 10-34 J·s
- Càrrega de l’electró: e = 1,602 x 10-19 C
- Massa en repòs de l’electró: me = 9,108 x 10-31 kg
- Constant dielèctrica al buit: k = 8,987 x 109 Nm2/C2
- Velocitat de la llum al buit: c = 2,998 x 108 m/s
En aquest treball es proposa comprovar la validesa de les equacions de Rydberg i Bohr per a la Sèrie de Balmer que és aquella en la que els electrons acaben en el nivell n = 2, que es troba en el visible, i determinar el valor de la constant de Rydberg, R.

Una vegada coneguda la constant de Rydberg (R), si es donen per conegudes la resta de constants, es pot determinar la constant de Planck o qualsevol altra de les constants involucrades a partir de la relació:
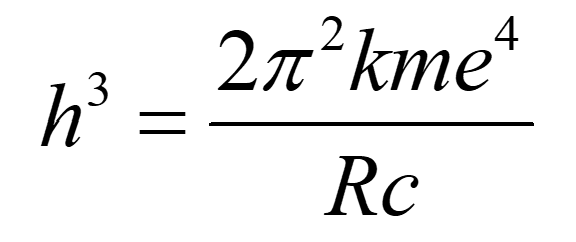
Material
Es necessita un tub espectral d’hidrogen que es connecta a una font d’alimentació d’alta tensió que excitarà el gas i emetrà la llum visible que s’analitza amb un espectroscopi de mà amb escala (quantitatiu).
Espectroscopi
A diferència de la majoria dels treballs al respecte que he vist publicats (també el del PSSC) i que utilitzen un espectre-goniòmetre per a mesurar les longituds d’ona de les línies, aquí proposo usar un espectroscopi de mà quantitatiu que indiqui directament el seu valor, de manera que l’alumnat no tingui la dificultat més gran en la manipulació d’un aparell.

S’ha d’utilitzar un espectroscopi que sigui capaç de mesurar el nanòmetre. També serveix si l’escala mesura els 10 nm, ja que es pot intercalar als 5 nm com a mínim i la imprecisió no sobrepassaria el 5%.
Espectroscopis d’aquesta mena que tinguin un error de mesura de ± 5 nm es poden comprar a preus relativament assequibles, com aquest de plàstic de la casa Ventus (61 €) o aquest de metall i amb cubeta de IBDCiencia (140 €).
Però també es poden construir de cartró o cartolina i així el jovent, en fer-los, pot arribar a entendre més bé el que estan fent servir. Explico com fer un amb una cartolina en una entrada de fa dies (2009), i Savall i altres (2014) en El espectroscopio cuantitativo como instrumento para la construcción y uso de modelos de emisión y absorción de radiación en física cuántica, indiquen com construeixen el seus a partir de capses de sabates i obtenen espectres com el de sota, de l’hidrogen.
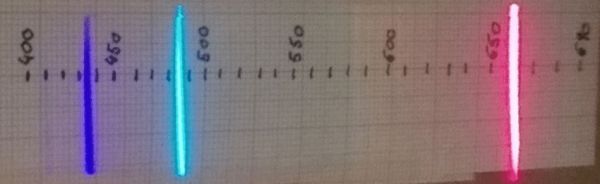
Els espectroscopis d’AstroMedia són de cartró i també s’han de muntar, venen amb escala per mesurar els valors de les longituds d’ona i, encara que són barats (8 €), funcionen molt bé.
Una alternativa a aquests espectroscopis de dalt és una xarxa de difracció directament davant el tub espectral, con proposa el professorat del laboratori docent del departament de Física de la Universitat Carlos III de Madrid per estudiar la sèrie de Balmer.
Tub espectral d’hidrogen
Aquest tub d’hidrogen es pot demanar als CRPs dels Serveix Educatius. També es pot comprar en les cases de material de laboratori per uns 30 €.

Tubs espectrals de mercuri
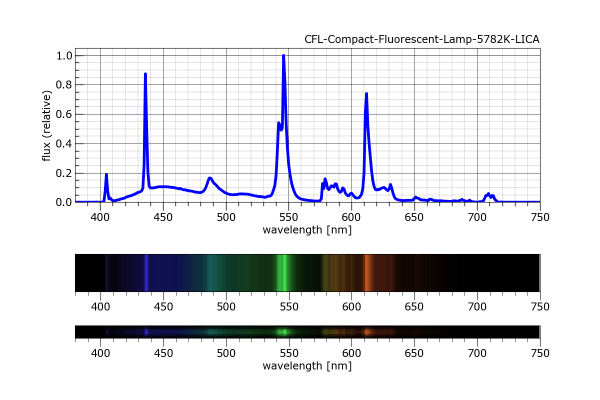
Les línies del mercuri o del sodi es poden utilitzar per a calibrar els espectroscopis. Es pot utilitzar un tub espectral de mercuri però és més fàcil fer servir un tub fluorescent o una bombeta de baix consum (fluorescent compacte) que també emeten les seves línies ja que contenen una mica de vapor de mercuri. Preferentment ha de ser un fluorescent de llum freda ja que així tenen més o menys la mateixa intensitat les ratlles blava i verda i taronja, que son les ratlles espectrals més interessants de les làmpades de baix consum, amb valors 436 (blava), 546 (verda) i 612 (taronja). Si la làmpada és de mercuri desapareix la línia taronja i es veu bé una groga a 577-579 nm.
A sota teniu dos espectres obtinguts per Carlos E. Tapia de làmpades del carrer dins un projecte Action sobre contaminació lumínica.
Com que s’estan canviant tant a les cases com als carrers totes les llums per leds, us recomano guardar un parell de bombetes de les que es deien de baix consum perquè ben aviat no hi haurà forma d’aconseguir una.
Font d’alimentació d’alta tensió
Conjuntament amb el tub d’hidrogen es pot demanar la font d’alta tensió als centres de recursos pedagògics (CRPs) dels Serveix Educatius. També es pot comprar una font d’alta tensió (uns 3000 V) en les cases de rètols lluminosos de neó per uns 20 €.

Encara hi ha més alternatives per aconseguir altes tensions com són, entre altres, els que els venedors anomenen generadors d’alta tensió de polsos, com el de la foto de la vora, que amb un voltatge d’entrada de 3 a 6 V de corrent continua generen una sortida de fins a 400 kV que pot generar un arc elèctric d’1 a 2 cm. Són molt barats, a partir de 2 €.
Procediment
Es connecta el tub d’hidrogen a la font d’alimentació i aquesta a la xarxa elèctrica. S’ha de parar compte amb no apropar-se massa al dispositiu una vegada en marxa ja que, encara que el corrent màxim que subministren aquestes fonts són 30 mA, la rampa a 3000 V pot ser forta. Millor si és el o la profe que corre el risc d’endollar el tub 😉.
Mirant amb l’espectroscopi al tub encès es veuen fàcilment tres de les ratlles brillants de l’hidrogen. Enfosquint l’habitació i esperant fins que els ulls s’hagin acostumat a la foscor, podrà veure’s també una quarta línia de l’hidrogen en el violeta llunyà. Algunes persones poden tenir certa dificultat fisiològica per veure la línia violeta més fosca.
A una taula com la que ve a continuació s’apunten les dades obtingudes amb l’espectroscopi. Estan incloses per a la comparació les longituds d’ona de la sèrie de Balmer. En concret, la línia verda del mercuri es pot utilitzar per a calibrar l’espectroscopi.

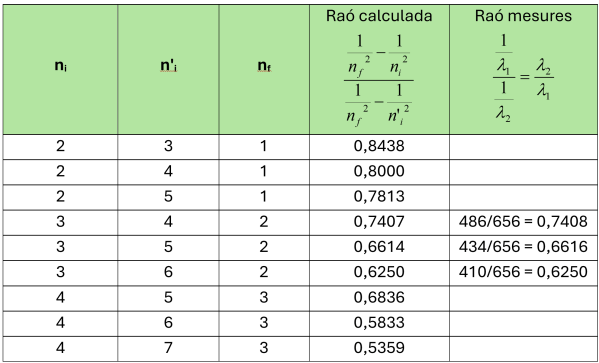
Per a trobar a quines transicions electròniques corresponen les línies espectrals de l’hidrogen de la sèrie del visible s’ha de completar la taula de sota que relaciona per una part els nivells energètics de l’àtom en l’equació de Rydberg per a diferents possibilitats de salt, i per una altra les diferents longituds d’ona obtingudes.
S’han de calcular doncs tant amb les raons dels inversos de la longitud d’ona per a cada parell de salts possibles (de 2 a 1, de 3 a 1, etc) com les raons de les inverses de les longituds mesurades amb l’espectroscopi. Les primeres raons o quocients s’han d’obtenir a partir de la proporció 1 (ja està calculada en la taula la primera raó com exemple):
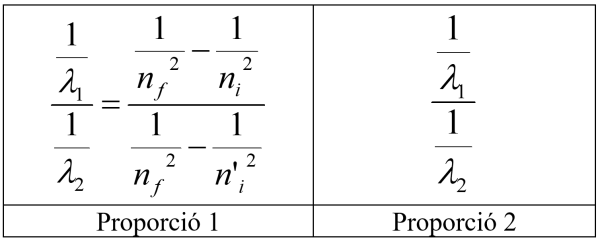
Els quocients de les longituds d’ona de l’hidrogen obtingudes experimentalment (proporció 2) s’han de col·locar en les files que més s’ajustin als valors per tal d’esbrinar a quines transicions correspon cada λ.
Una vegada que es troba a quina longitud d’ona correspon cada transició ja es pot calcular R per a cada línia espectral λ, i donar per bona la mitjana aritmètica dels valors obtinguts.
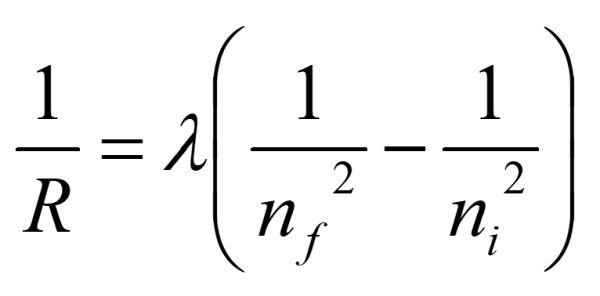
Resultats previsibles
Per tant
656 nm corresponen a la transició n =3 a n = 2
486 nm corresponen a la transició n =4 a n = 2
434 nm corresponen a la transició n =5 a n = 2
410 nm corresponen a la transició n =6 a n = 2
El valor de R per l’hidrogen hauria de sortir al voltant de: 1,097 x 107 m-1
Alternativa
Si no es disposa del material per a realitzar l’experiència sempre es poden realitzar el càlculs que es proposen en aquest protocol ja que els valors de les longituds d’ona de l’espectre de l’àtom d’hidrogen sempre se’ls hi pot proporcionar a l’alumnat.




Permitid dos enlaces y una foto…
https://www.educaplus.org/game/espectros-atomicos
https://cienciayelazarrelativo.blogspot.com/p/espectroscopio.html
Gracias y un abrazo QuintÃn
Muchas gracias a ti
Lorenzo
[…] llum que emeten els leds heu de fer-vos amb un espectròmetre. Com he indicat altres vegades, com en l’entrada L’espectre de l’hidrogen i la constant de Rydberg, podeu aconseguir un comprant-lo, o millor construint-lo de […]
[…] podeu mirar l’entrada https://experimentaciolliure.com/2025/03/12/lespectre-de-lhidrogen-i-la-constant-de-rydberg/ que utilitza l’anàlisi de les ratlles espectrals emeses per un tub de descàrrega d’hidrogen […]